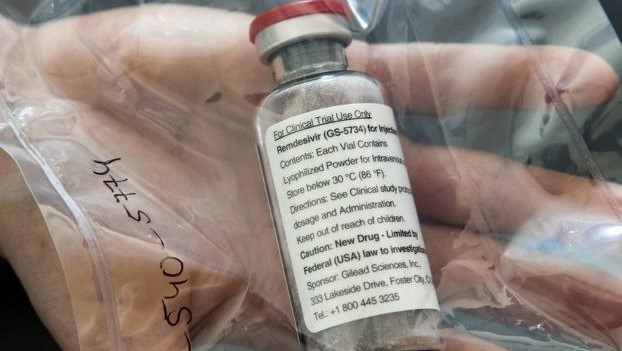
La Agencia Europea del Medicamento (EMA, por sus siglas en inglés) anunció el jueves que dio luz verde al primer medicamento para luchar contra el Covid-19, aunque lo hizo con condiciones.
El fármaco es el remdesivir, que fabrica la empresa estadounidense Gilead, y podrá usarse en pacientes adultos y niños mayores de doce años que sufran neumonía y requieran oxigenación. El visto bueno es provisional, a falta de que la Comisión Europea de su aprobación la semana próxima para la venta del medicamento con el nombre comercial de Veklury.
La decisión del comité de medicinas de la EMA se ha realizado en un tiempo "excepcionalmente corto", a través de un procedimiento de revisión continua, señaló EFE.
Este mecanismo solo es usado por la agencia radicada en Ámsterdam durante emergencias de salud pública para evaluar los datos a medida que estén disponibles. Un enfoque similar al que utiliza la Organización Mundial de la Salud (OMS) para el ébola, la enfermedad a la que estaba destinado el antiviral desarrollado por Gilead desde 2009.
Sin embargo, diferentes pruebas realizadas con otros coronavirus similares al SARS-CoV-2 dieron buenos resultados y abrieron la posibilidad de realizar diferentes ensayos clínicos en Wuhan (China), Estados Unidos y otros países azotados con dureza por la pandemia, como Italia o España, donde más de una decena de hospitales participan en los ensayos clínicos.
La EMA explicó que desde el 30 de abril estudia los datos sobre calidad y fabricación, así como parámetros clínicos, no clínicos, clínicos preliminares y de seguridad antes de que la compañía pidiera la autorización el 5 de junio.
La agencia se ha basado principalmente, aunque también ha tenido en cuenta otros trabajos, en el estudio NIAID-ACTT-11, impulsado por el Instituto Nacional de Alergias y Enfermedades Infecciosas de Estados Unidos que se publicó hace un mes en la revista The New England Journal of Medicine.
Este trabajo, desarrollado en mil enfermos hospitalizados por el Covid-19, concluyó que los pacientes que habían recibido el fármaco se recuperaban cuatro días antes de aquellos que habían tomado un placebo.
Esa diferencia no se observó en pacientes con cuadros leves o moderados o en aquellos que ya estaban en ventilación mecánica. En cambio, en los casos más graves se observó que el tiempo de recuperación fue de 12 días en el grupo de remdesivir y de 18 días en el grupo de placebo.
Tras analizar todos estos datos, la Agencia Europea del Medicamento consideró que "el balance de beneficios y riesgos había demostrado ser positivo en pacientes con neumonía que requieren oxígeno suplementario; es decir, los enfermos graves".
La EMA aclara que el remdesivir se administra por vía intravenosa en aquellos centros de salud donde el paciente puede ser monitorizado de cerca y el tratamiento debe comenzar "con 200 miligramos el primer día, seguido de 100 miligramos al día durante al menos cuatro días, y no más de nueve días".
La agencia recalca que su recomendación es para una "comercialización condicional, mecanismo que le permite recomendar un medicamento con datos menos completos de lo habitual para un fármaco que espera salir a la venta, "si el beneficio de la disponibilidad inmediata de un medicamento para los pacientes supera el riesgo inherente al hecho de que aún no están disponibles todos los datos".
Pero la última palabra la tendrá la Comisión Europea la semana próxima.
En Europa todavía no se había aprobado el uso de ningún medicamento específico contra el coronavirus. Los profesionales sanitarios han combatido la enfermedad hasta ahora recurriendo a varios fármacos, como la dexametasona o los anticuerpos monoclonales.